В последние годы особый интерес отечественных и зарубежных исследователей вызывает проблема профилактики и лечения жировой болезни печени. В контексте этого митохондриальная дисфункция, формирующаяся при данном заболевании, рассматривается как один из ведущих патогенетических факторов, поскольку является промежуточным звеном между избыточным поступлением свободных жирных кислот (СЖК) в гепатоциты и развитием окислительного стресса.
РОЛЬ МИТОХОНДРИЙ В ЭНЕРГЕТИЧЕСКОМ ГОМЕОСТАЗЕ В ПЕЧЕНИ
Митохондрии являются наиболее многочисленными органеллами гепатоцитов, занимающими примерно 20% объема клеток. Важнейшая роль митохондрий в клеточной энергопродукции в ходе окислительного фосфорилирования обусловлена чрезвычайно высокими потребностями гепатоцитов в АТФ, которые определяются такими энергозависимыми процессами, как секреция желчных кислот, глюконеогенез, протеинсинтез, образование мочевины, сохранение ионного гомеостаза, обмен холестерина и многие другие. Именно поэтому повреждение митохондрий и нарушение их функций приводят к самым тяжелым последствиям для гепатоцитов, вплоть до их гибели[2, 3].
При адекватном кровоснабжении бо́льшая часть ацетил-КоА образуется за счет окисления СЖК, а остальное количество — за счет декарбоксилирования пировиноградной кислоты, одна часть которой образуется в процессе гликолиза, а другая — из лактата, поступающего в клетку из крови. Гепатоциты получают АТФ благодаря расщеплению ацетил-КоА в цикле Кребса, при этом основными источниками энергии выступают глюкоза и СЖК. По сравнению с гликолизом катаболизм СЖК требует большего количества кислорода для синтеза эквивалентного количества АТФ. Митохондрии ответственны за окисление как коротко-, так и средне- и длинноцепочечных жирных кислот (ЖК), в то время как β-окислению в пероксисомах подвергаются только длинноцепочечные ЖК[2].
Метаболизм СЖК зависит от различных факторов: уровня малонил-КоА, соотношения ацетил-КоА/КоА и доступности субстратов. Долгосрочное регулирование этого процесса опосредуется влиянием на ядерные транскрипционные факторы, такие как рецепторы, активируемые пероксисомными пролифераторами (PPARs). Ингибирование митохондриального β-окисления ЖК в результате действия различных факторов (генетический дефект, лекарственное воздействие, нарушение метаболизма, разобщение процессов окисления и фосфорилирования в митохондриях) в конечном счете приводит к внутриклеточному накоплению СЖК и повреждению клеточных структур (рис.)[3, 7, 8].
Рис. Роль повреждающих факторов в развитии гиперпродукции активных форм и соединений кислорода при митохондриальной дисфункции[7].
Примечание. ДНК — дезоксирибонуклеиновая кислота; НЖБП — неалкогольная жировая болезнь печени; СЖК — свободные жирные кислоты; HBV — вирус гепатита B; HCV — вирус гепатита C; Il — интерлейкин; TNF — фактор некроза опухоли
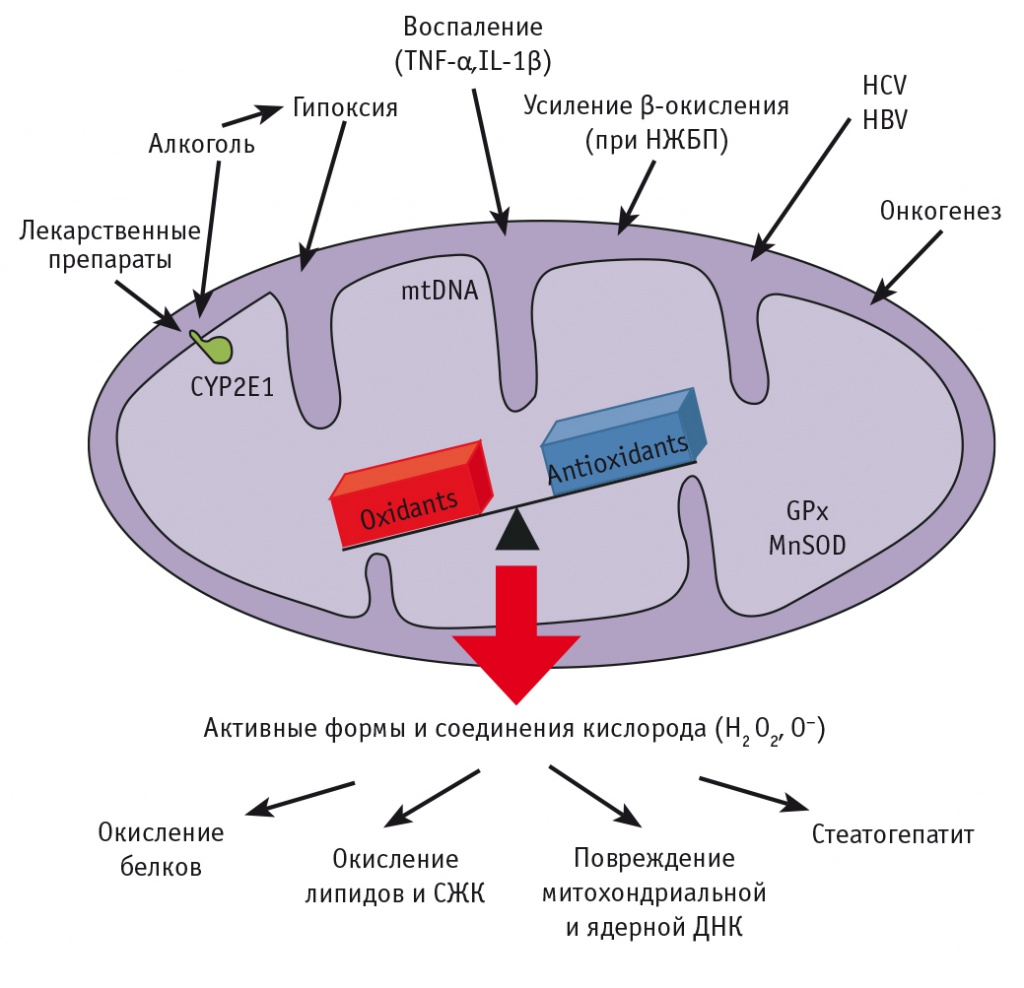
МИТОХОНДРИАЛЬНАЯ ДИСФУНКЦИЯ ПРИ РАЗЛИЧНЫХ ПОРАЖЕНИЯХ ПЕЧЕНИ
C. Day и соавт. в 1998 г. выдвинули оригинальную гипотезу формирования стеатоза печени при неалкогольной жировой болезни печени. Согласно ей первым толчком в патогенезе заболевания является избыточное поступление в гепатоциты СЖК, на фоне которого развивается оксидативный стресс (второй толчок). Утрата клеточного контроля над процессами свободнорадикального окисления приводит к повреждению клеточных мембран и ферментов, исчерпанию фонда эндогенных антиоксидантов, увеличению секреции провоспалительных цитокинов с инициацией апоптоза или некроза гепатоцитов, формированием воспаления, а в дальнейшем фиброза печени и увеличением риска развития гепатоцеллюлярной карциномы[6].
В процессе развития стеатоза печени происходит метаболическая адаптация, направленная на ограничение скорости и выраженности этого процесса. Главный механизм — стимуляция митохондриального и пероксисомального окисления СЖК, которое призвано утилизировать избыток субстрата с увеличением производства АТФ, расходующегося в первую очередь для липогенеза и глюконеогенеза. Так, увеличение митохондриального окисления СЖК было обнаружено у пациентов с жировым гепатозом и у тучных пациентов с признаками метаболического синдрома. У грызунов аналогичный процесс индуцировался перекармливанием или введением L-глутамата натрия[3].
В ходе митохондриального окисления СЖК образуется ацетил-КoA, который окисляется в цикле Кребса с образованием восстановленного никотинамидадениндинуклеотида (НАДН), сукцината и гуанозинтрифосфата. Далее сукцинат и НАДН поступают в дыхательную цепь с образованием АТФ. Большинство электронов в дыхательной цепи мигрируют вдоль нее, чтобы, достигнув цитохром С-оксидазы (дыхательный комплекс IV) при участии протонов, восстановить кислород, образуя воду. Однако частичная утечка электронов из дыхательных комплексов I и III приводит к образованию активных форм и соединений кислорода (АФСК), например гидроксильного радикала. В норме он инактивируется супероксиддисмутазой до перекиси водорода, которая в дальнейшем разрушается глутатионпероксидазой. Таким образом, большинство митохондриальных АФСК обычно нейтрализуются, а оставшиеся выполняют роль сигнальных молекул. Однако любое значительное усиление деятельности митохондриальной дыхательной цепи может вызвать перепроизводство АФСК, спровоцировав окислительный стресс. Повышенный приток СЖК в митохондрии может поставить под угрозу функции митохондрий, вызвав разобщение процессов окисления и фосфорилирования и гиперпродукцию АФСК[4, 8]. Таким образом, митохондриальная дисфункция, результатом которой является несоответствие энергопродукции в ходе окислительного фосфорилирования энергетическим потребностям клетки, выступает фактором, предшествующим развитию оксидативного стресса при стеатозе печени (см. рис.).
Утечка электронов из дыхательной цепи приводит к митохондриальной недостаточности и накоплению СЖК в цитозоли. В этом случае ряд авторов обнаружили прогрессивное снижение активности II комплекса дыхательной цепи (сукцинатоксидазы) при относительно неизмененной или несколько сниженной активности I дыхательного комплекса[3].
Активность II комплекса, а соответственно и энергопродукцию, можно определенное время поддерживать при условии наличия в митохондриях субстрата окисления в данном звене — сукцината (янтарной кислоты). Это ФАД-зависимое звено цикла Кребса при гипоксии угнетается позже, чем НАД-зависимые оксидазы (ФАД — флавинадениндинуклеотид, НАД — окисленная форма никотинамидадениндинуклеотида)[1].
Накопление СЖК в цитозоли активирует альтернативные пути пероксисомального и микросомального окисления СЖК, в результате чего образуется еще большее количество АФСК. В начальной стадии пероксисомального окисления образование перекиси водорода происходит в результате действия ацетил-КоА-оксидазы, которая отдает электроны непосредственно молекулярному кислороду. Микросомальное окисление СЖК (ω-окисление), катализируемое ферментами цитохрома Р450 (CYP2E1, CYP4A10, CYP4A14), формирует АФСК путем флавопротеинопосредованной передачи электронов на молекулярный кислород. Кроме того, дикарбоновые кислоты — еще один продукт микросомального окисления СЖК — могут ухудшать функцию митохондрий, разобщая окислительное фосфорилирование[4, 11].
Нарушение электронного потока в дыхательной цепи также уменьшает повторное окисление НАДН в НАД+. Одним из следствий падения уровня НАД+ является снижение окисления пирувата пируватдегидрогеназным комплексом. В результате пируват недостаточно утилизируется и из-за высокого соотношения НАДН/НАД+ превращается в лактат, накопление которого может вызвать молочный ацидоз. Другим следствием относительного недостатка НАД+ и ФАД является уменьшение β-окисления ЖК, которые могут эстерифицироваться с образованием триглицеридов, откладывающихся затем в гепатоцитах в жировых вакуолях или включающихся в липопротеиды очень низкой плотности[11]. Острое, выраженное нарушение митохондриального окисления ЖК, как правило, вызывает микровезикулярный стеатоз. Когда нарушение имеет затяжной характер, возникают смешанные формы стеатоза.
Неинвазивный функциональный тест с кетоизокапроновой кислотой, использующийся для оценки функций митохондрий у пациентов с жировой болезнью печени, показал, что по мере прогрессирования стеатоза в стеатогепатит митохондриальное декарбоксилирование кетоизокапроновой кислоты прогрессивно снижается, это свидетельствует о падении интенсивности клеточного дыхания[3].
Хроническое употребление алкоголя является независимым фактором развития и прогрессирования митохондриальной дисфункции. При этом происходят изменения в структуре (набухание, изменение размера и формы) и функциях митохондрий. Кроме того, алкоголь может влиять на состав фосфолипидов, изменяя проницаемость мембран, хотя достоверно не известно, влияет ли это на функции митохондрий. Показано, что митохондрии из печени животных, подвергавшихся воздействию алкоголя, содержат пониженное количество компонентов дыхательной цепи и ферментного комплекса, который опосредует производство АТФ. В результате скорость синтеза АТФ в митохондриях печени снижается. Наконец, алкоголь может изменять содержание белка в митохондриях, что влияет на их способность синтезировать АТФ[5].
Алкоголь вызывает относительный недостаток кислорода в печени за счет расходования его в процессе детоксикации. При работе алкоголь- и ацетальдегиддегидрогеназы происходит быстрое истощение пула НАД+[9]. Кроме того, употребление алкоголя обусловливает увеличение проницаемости стенок кишечника, что, в свою очередь, приводит к росту поступления бактериальных эндотоксинов в кровь, провоцируя иммунный ответ, повышая активность клеток печени и потребление ими кислорода. Развивающаяся при этом гипоксия значительно снижает способность митохондрий к производству АТФ[5].
Инфицирование гепатотропными вирусами также может приводить к развитию митохондриальной дисфункции. Установлено, что одним из мест локализации core-протеина HCV является митохондриальная мембрана. Это облегчает вход Ca2+ в митохондрии и индуцирует увеличение проницаемости их мембран. Происходит стимуляция электронного транспорта, что влечет за собой повышение продукции АФСК, которое обусловливает рост активности NO-синтазы, участвующей в процессах воспаления, повреждения ДНК и гибели клеток. Истощение пула восстановленного глутатиона и потеря митохондриями цитохрома С нарушают функции митохондрий и приводят к еще большему производству АФСК в гепатоцитах. Дополнительно происходит снижение плотности рецепторов к адипонектину, что способствует развитию системной резистентности к инсулину и другим метаболическим аномалиям[10, 12].
ЗАКЛЮЧЕНИЕ
Таким образом, оценка роли митохондриальной дисфункции обеспечивает более глубокое понимание патогенеза заболеваний печени и может служить основой для разработки рациональной диагностической и терапевтической стратегии. Разработка препаратов, способных корригировать митохондриальное окислительное фосфорилирование и восстанавливать активность дыхательной цепи, позволит повысить эффективность фармакотерапии у больных с различными заболеваниями печени.







