Ежегодно в мире фиксируются сотни тысяч случаев внезапной сердечной смерти (ВСС). В Российской Федерации регистрируют около 200 000–250 000 случаев в год1. Одним из наиболее распространенных наследственных заболеваний, приводящих к ВСС, является врожденный синдром удлиненного интервала QT (СУИQT; long QT syndrome, LQTS).
Первые упоминания о данном синдроме датируются 1957 г., когда А. Jervell и F. Lange-Nielsen описали заболевание с сочетанием врожденной глухоты, удлиненного интервала QT на электрокардиограмме (ЭКГ) и частых приступов потери сознания у нескольких членов одной семьи[1]. Затем в 1964 г. независимо друг от друга итальянский и ирландский педиатры С. Romano и О. Ward представили примеры случаев с аналогичной клинической картиной, но без врожденной глухоты[2, 3]. Несколько лет спустя, в 1975 г., был введен термин «синдром удлиненного интервала QT».
СУИQT — наследственное заболевание, в основе которого лежит дисфункция ионных каналов и насосов, проявляющееся удлинением интервала QT на ЭКГ (при отсутствии других причин, вызывающих это изменение), рецидивирующими синкопальными и пресинкопальными состояниями вследствие пароксизмов полиморфной желудочковой тахикардии по типу «пируэт» (torsade de pointes, TdP), а также случаями ВСС[4].
Распространенность СУИQT в общей популяции составляет порядка 1 : 2000[5]. Необходимо заметить, что в это число входят больные, у которых зафиксировано удлинение интервала QTc (корригированного) на ЭКГ, и не учитывает тех, у кого был положительный генотип, по данным молекулярного скрининга, но нормальная длительность QTc. Следовательно, истинная распространенность патологии, вероятно, куда больше.
ГЕНЕТИЧЕСКАЯ ГЕТЕРОГЕННОСТЬ СИНДРОМА УДЛИНЕННОГО ИНТЕРВАЛА QT
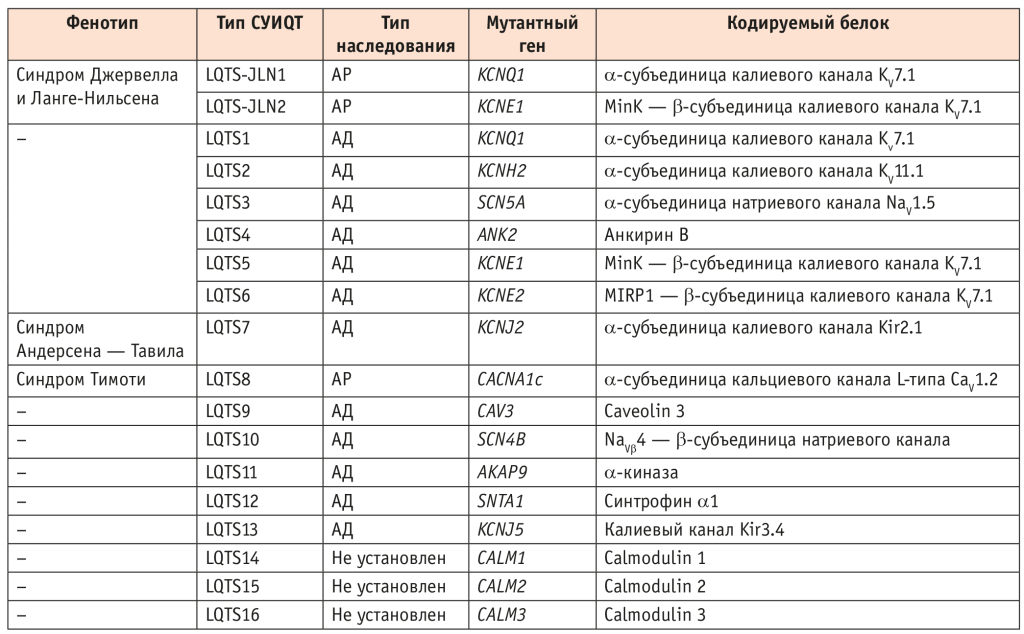
Молекулярная основа СУИQT вариабельна, и на сегодняшний день описаны мутации в 16 генах, ответственных за возникновение этого врожденного заболевания (табл. 1)[6]. Среди известных в настоящее время различных типов СУИQT наиболее распространены LQTS1, LQTS2 и LQTS3, в основе которых лежат дефекты генов KCNQ1, KCNH2 и SCN5A соответственно, кодирующих белки ион-селективных каналов; 75% всех случаев синдрома вызваны дефектами этих трех генов[6, 7].
Таблица 1. Молекулярно-генетические типы врожденного синдрома удлиненного интервала QT (СУИQT)[4]
LQTS1, JLNS1, JLNS2
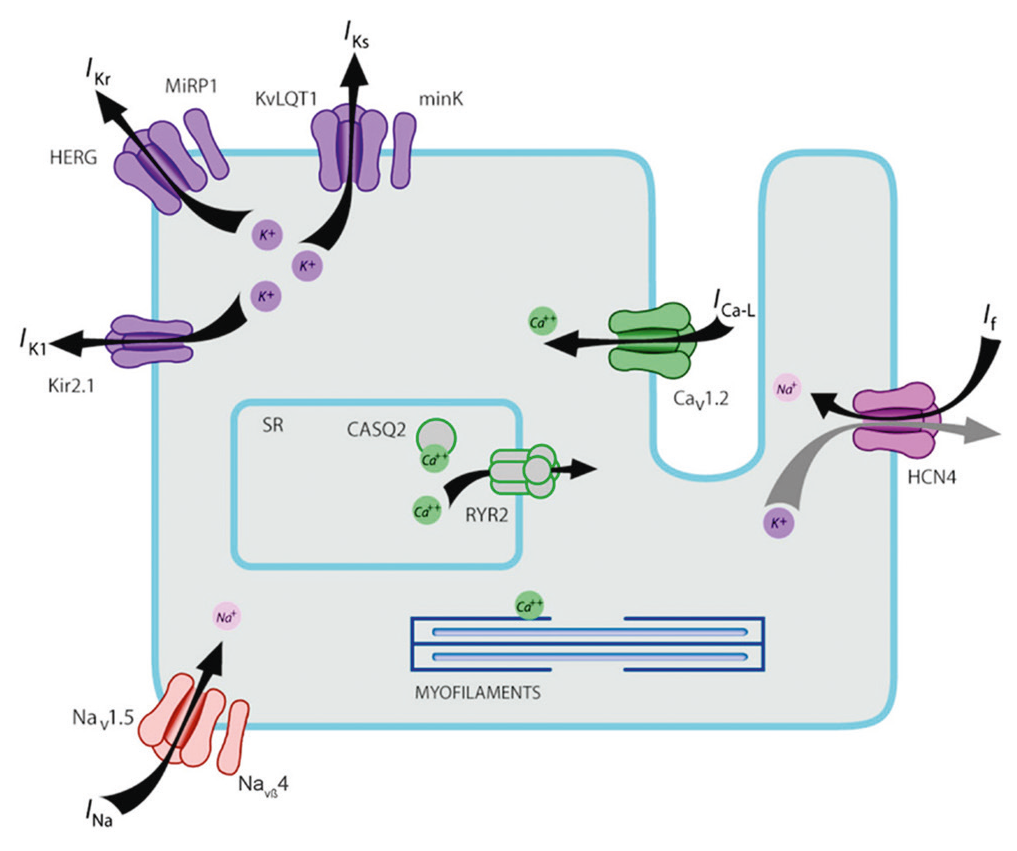
LQTS1 — наиболее распространенный тип врожденного СУИQT, возникающий в результате мутации в гене KCNQ1, кодирующем α-субъединицу калиевого канала KV7.1[7]. Выяснилось, что для генерации медленного компонента тока ионов K+ (IKs), помимо порообразующей субъединицы KV7.1, необходимо наличие модуляторной β-субъединицы minK, кодируемой геном KCNE1 (рис. 1).
Рис. 1. Схематичное изображение кардиомиоцита, на котором представлена молекулярная структура только тех ионных каналов, которые участвуют в патогенезе синдрома удлиненного интервала QT[9]
Подавляющее большинство мутаций, возникающих в описанных генах, являются миссенс-мутациями. Нарушения ритма сердца у носителей таких генетических дефектов провоцируются адренергической стимуляцией, например эмоциональным стрессом и физической нагрузкой[8].
Отсутствие возможности адаптировать длину интервала QT к увеличению частоты сердечных сокращений (ЧСС) во время симпатической активации приводит к выраженному проаритмогенному состоянию.
Довольно редко встречаются гомозиготные или компаунд-гетерозиготные мутации в генах KCNQ1 и KCNE1, которые могут вызывать рецессивные формы заболевания — синдром Джервелла и Ланге-Нильсена 1 и 2 типов (JLNS1, JLNS2)[10]. Наследственные дефекты, изменяющие структуру и функции α- и β-субъединиц калиевых каналов, способны приводить к снижению ионных токов IKs не только в мембранах кардиомиоцитов, но и во внутреннем ухе. Если остаточная активность калиевых каналов внутреннего уха снизится на 10–20% от нормального, то этого будет достаточно для адекватного ионного гомеостаза эндолимфы, а следовательно, для нормального слуха — синдром Романо — Уорда. В случае, если уровень IKs снизится еще сильнее, вплоть до нуля, развивается нейросенсорная тугоухость, что характерно для JLNS1 и JLNS2[10].
LQTS2
Данный тип СУИQT столь же распространен, как и LQTS1, он встречается примерно у 35–40% пациентов с доказанной мутацией[11]. LQTS2 возникает в результате дефекта в гене KCNH2 (HERG), кодирующем α-субъединицу калиевого канала KV11.1, ответственного за быстрый компонент трансмембранного тока ионов K+ (IKr)[12].
Мутации в указанном гене нарушают функцию канала KV11.1, увеличивая продолжительность интервала QT. По данным различных авторов, около 29% синкопальных состояний возникают в покое либо во время сна и только 13% — во время физической нагрузки[11, 12]. Характерной особенностью этого типа СУИQT является наличие таких провоцирующих факторов, как внезапные громкие звуки, например звон будильника либо звонки в дверь[11].
LQTS3
LQTS3 — менее распространенный тип СУИQT, обусловленный мутацией по типу gain of function (усиление функции) в гене SCN5A, кодирующем α-субъединицу потенциал-зависимого Na+-канала (NaV1.5)[13].
LQTS3 вызван мутацией «усиления функции», которая нарушает быструю инактивацию α-субъединицы, что приводит к продолжающемуся входящему току ионов Na+ (INa) и, как следствие, к увеличению фазы реполяризации кардиомиоцитов. Около 39% пациентов с данным типом СУИQT испытывают большинство клинических проявлений во время сна либо отдыха, и около 13% событий происходят во время физической нагрузки[14].
LQTS4
LQTS4 развивается в результате мутации по типу loss of function (снижение функции) в гене ANK2, кодирующем анкирин B[15].
Анкирин B — цитоскелетный белок, играющий важную роль в обеспечении правильной локализации и стабилизации Na+/Ca2+-обменника, Na+-К+-АТФазы, а также рецепторов IP3 (IP3R), которые опосредуют высвобождение ионов кальция в цитоплазму кардиомиоцитов[15].
LQTS4 характеризуется внутриклеточной перегрузкой Ca2+, возникающей в результате нарушения транспорта ионов, что способствует увеличению интервала QT.
LQTS5
Совместная экспрессия генов KCNQ1 и KCNE1, кодирующих α- и β-субъединицы (MinK) калиевых каналов (KV7.1) соответственно, является ключом к генерации медленного компонента ионного тока IKs[10].
Из этого следует, что мутация в гене KCNE1 приводит к задержке реполяризации кардиомиоцитов из-за снижения генерации тока IKs, что выражается в удлинении интервала QT на ЭКГ.
Если способ наследования дефектного гена аутосомно-рецессивный, то развивается синдром Джервелла и Ланге-Нильсена 2 типа (JLNS2).
LQTS6
Данный тип СУИQT, обусловленный мутацией в гене KCNE2, кодирующем модуляторные β-субъединицы (MinK-родственные пептиды 1, MiRP1) калиевых каналов (KV7.1), встречается довольно редко[16].
Мутации в этом гене приводят к нарушениям быстрого компонента трансмембранного калиевого тока (IKr). Слуховые раздражители также могут провоцировать приступы синкопальных состояний у носителей дефектного гена KCNE2, подобно мутациям в KCNH2 [16].
LQTS7
Синдром Андерсена — Тавила (ATS) — довольно редкая форма заболевания с аутосомно-доминантным типом наследования, для которой характерно удлинение интервала QT в сочетании с наличием аномальной волны U, частыми пароксизмами полиморфной желудочковой тахикардии по типу TdP, двунаправленной желудочковой тахикардией[13].
Мутация по типу loss of function возникает в гене KCNJ2, который кодирует α-субъединицу калиевого канала Kir2.1, обеспечивающего трансмембранный ионный ток (IK1)[13].
При ATS также встречаются внешние признаки дисморфогенеза: гипертелоризм, гипоплазия нижней челюсти, низкое расположение ушных раковин, клинодактилия, сколиоз, низкорослость.
LQTS8
Причиной LQTS8 (синдрома Тимоти) является мутация по типу gain of function в гене CACNA1с, который кодирует порообразующую α-субъединицу потенциал-зависимого кальциевого канала L-типа CaV1.2, генерирующего трансмембранный ток ионов Ca2+ (ICa-L)[17].
Данный тип СУИQT — чрезвычайно редкое генетическое мультисистемное заболевание, включающее, помимо выраженного удлинения интервала QT, синдактилию, черепно-лицевые аномалии, врожденные пороки сердца, а также аутизм.
Чаще всего синдром Тимоти возникает как миссенс-мутация de novo G406R в 8а экзоне гена CACNA1C. При этом резко нарушается потенциал-зависимая инактивация CaV1.2, что, в свою очередь, приводит к увеличению входящего тока ионов кальция, который продлевает трансмембранный потенциал действия, — классический вариант LQTS8[17].
LQTS9, LQTS10
В основе LQTS9 лежит мутация в гене CAV3, который кодирует белок кавеолин 3, образующий специальные мембранные домены — кавеолы. Кавеолин 3 связывается со множеством различных белковых структур, включая белки ионных каналов[14].
Ген SCN4B кодирует вспомогательную β-субъединицу (NаVβ4) натриевого канала, вызывая усиленный ток ионов Na+ через натриевый канал NаV1.5[14].
Подобно LQTS3, мутации в генах CAV3 и SCN4B приводят к увеличению входящего тока INa и, как следствие, к удлинению фазы реполяризации кардиомиоцитов.
LQTS11
Данный тип СУИQT развивается вследствие мутации в гене AKAP9, кодирующем якорный белок А-киназы, который путем взаимодействия с α-субъединицей калиевого канала KV7.1 приводит к угнетению медленного компонента тока ионов K+ (IKs)[6].
LQTS12
В основе этого типа СУИQT лежит мутация в гене SNTA1, который кодирует синтрофин α1, входящий в семейство каркасных цитоплазматических белков мембраны и регулирующий ток ионов Na+ (INa)[18].
G. Wu и соавт. проанализировали ген SNTA1 у 39 пациентов с СУИQT, у которых не было мутаций в 9 известных генах, связанных с LQTS, и выявили новую миссенс-мутацию у двух женщин и одного мальчика[18]. У 17-летнего мальчика был врожденный СУИQT с выраженным удлинением интервала QT (550 мс), которое зафиксировали на ЭКГ через 6 часов после рождения. В возрасте 3 лет у него случился обморок, и ему было проведено холтеровское мониторирование ЭКГ, которое подтвердило удлинение интервала QT. У сестры пациента, матери, дяди и бабушки по материнской линии также наблюдалось удлинение интервала QT на ЭКГ (от 460 до 530 мс). Дядя, у которого в анамнезе были обмороки, внезапно умер в возрасте 25 лет во время физической нагрузки.
LQTS13
СУИQT 13 типа (LQTS13) вызывается гетерозиготной мутацией в гене KCNJ5 на хромосоме 11q24, который кодирует чувствительные к G-белку калиевые каналы Kir3.4[19].
Y. Yang и соавт. изучали большую китайскую семью в четырех поколениях с верифицированным СУИQT[19]. Пробандом была 62-летняя женщина с 40-летним анамнезом синкопальных эпизодов. По данным эхокардиографии, структурные или функциональные нарушения сердца не найдены, однако на ЭКГ удлинение интервала QT было очевидным (QTc 520 мс). Последующая оценка 49 членов семьи выявила 9 пациентов с СУИQT, характеризующихся сходными клиническими признаками. У женщины был младший брат, у которого после рождения была серия судорог и синкопальных эпизодов, и он внезапно умер на 7-е сутки жизни. Вскоре выполнили полногеномный анализ, по результатам которого обнаружена миссенс-мутация, локализованная в гене KCNJ5 на хромосоме 11q23.3-q23.4.
LQTS14, LQTS15, LQTS16
Кальмодулин — широко распространенный кальций-связывающий белок, способный регулировать большое количество различных молекулярных процессов в клетках. Три гена, CALM1, CALM2 и CALM3, имеют уникальные нуклеотидные последовательности, но кодируют идентичный протеин — кальмодулин. Индуцированная кальцием активация кальмодулина регулирует многие кальций-зависимые процессы и модулирует функцию ионных каналов сердца, включая CaV1.2, NaV1.5 и рианодиновый рецептор (RYR2)[20].
N. Boczek и соавт. выполнили геномное секвенирование 38 пациентов с СУИQT, у которых не было мутаций в 14 известных генах, связанных с LQTS, и выявили 5 (13,2%) пациентов, имеющих мутации в генах кальмодулина: трое в CALM1 (LQTS14) и двое в CALM2 (LQTS15)[20].
КЛИНИЧЕСКАЯ КАРТИНА
Основными характерными клиническими проявлениями СУИQT являются синкопальные состояния (> 80%)[7]. ВСС происходит сравнительно редко (< 9%)[7]. Примерно у 50% из симптомных пациентов клинические признаки патологии сердца манифестируют к 12 годам и почти у 90% — к 40 годам[21]. Средний возраст постановки диагноза СУИQT у лиц с симптомами — первая или вторая декада жизни, тогда как у бессимптомных пациентов диагноз обычно верифицируется на третьем десятке лет жизни[21]. Большинство аритмий, возникающих в рамках СУИQT, имеют желудочковое происхождение[22].
TdP — особый вид полиморфной желудочковой тахикардии. Термин был впервые предложен F. Dessertenne, который описал характерную электрокардиографическую картину данного вида аритмии c непрерывно меняющейся морфологией комплексов QRS, напоминающих «пируэт». D. Roden и соавт. обратили внимание на то, что уменьшение ЧСС способствует возникновению TdP[23].
Наиболее типичной картиной, непосредственно предшествующей началу TdP, является последовательность, именуемая long-short-long, которая впервые описана G. Kay и соавт. следующим образом: «За преждевременным желудочковым сокращением следует компенсаторная пауза, после которой возникает наджелудочковая экстрасистола. Затем появление преждевременной желудочковой экстрасистолы инициирует запуск TdP»[24].
TdP часто провоцируется внешними раздражителями. Плавание в результате активации симпатической и парасимпатической систем может запускать катехоламинергическую полиморфную желудочковую тахикардию. Провоцирующим фактором для LQTS2 является острое возбуждение, инициируемое, к примеру, внезапным слуховым раздражителем[11]. Большинство клинических проявлений LQTS3 происходят в состоянии покоя или во время сна.
Как упоминалось ранее, гомозиготные или компаунд-гетерозиготные мутации в гене KCNQ1 могут привести к синдрому Джервелла и Ланге-Нильсена, для которого характерна, помимо удлинения интервала QT на ЭКГ, врожденная нейросенсорная тугоухость[10]. Описана связь между синдромом внезапной детской смерти (СВДС) и LQTS[26]. По самым последним данным, СУИQT является причиной до 5–10% всех СВДС[25].
ДИАГНОСТИКА
Постановка диагноза врожденного СУИQT сопряжена с определенными сложностями. В настоящее время существует тенденция к гипердиагностике СУИQT, который чаще всего ошибочно интерпретируют в контексте вазовагальных обмороков, ассоциированных с пограничной величиной интервала QT на ЭКГ, либо в рамках эпилепсии.
Для того чтобы правильно верифицировать диагноз, необходимы нижеперечисленные процедуры.
-
Тщательный сбор подробного анамнеза с особым вниманием к случаям потери сознания и ВСС у ближайших родственников[4].
-
Исключение развития приобретенного СУИQT (причины — электролитные нарушения, гипотиреоз, нарушение питания, внутричерепное кровоизлияние, интоксикация фосфорорганическими веществами, перенесенный инфаркт миокарда и др.)[4].
-
Анализ ЭКГ, в частности необходимо правильно интерпретировать интервал QT. Он измеряется от начала комплекса QRS до места пересечения касательной, проведенной через точку максимального наклона нисходящей части зубца Т, с изоэлектрической линией. Рекомендуется его оценивать в отведениях II или V5. Зубец U, который может следовать за зубцом T, не должен включаться в интервал QT. Для того чтобы нивелировать влияние ЧСС на длительность интервала QT, рекомендуется использовать величину корригированного интервала QT, рассчитанную по формуле Базетта: QTc = QT/√RR. Следует помнить, что определение QTc при ЧСС менее 60 либо более 100 в минуту осуществляется по формуле Sagie (Framingham): QT (QTc) = QT + (0,154 × (1 – RR)) × 1000[26].
-
Проведение суточного мониторирования ЭКГ по Холтеру, имеющего ряд преимуществ, особенно в случаях с LQTS2 и LQTS3, которые часто манифестируют в ночное время[4].
-
Нужно рассмотреть использование провокационных проб в неоднозначных клинических ситуациях; парадоксальное удлинение интервала QT (> 30 мс) на фоне инфузии низких доз адреналина (0,05 мкг/кг/мин) имеет положительную прогностическую ценность в 75% случаев[4]. Что касается пробы с дозированной физической нагрузкой на тредмиле или велоэргометре, длительность QTc ≥ 460 мс во время фазы восстановления характерна для пациентов с LQTS1[4].
-
Молекулярно-генетическое тестирование помогает выявить около 80% пациентов с диагнозом LQTS, однако отрицательный результат, по данным этого метода, не позволяет с полной уверенностью исключить синдром, поскольку в 20% случаев не удается идентифицировать генетический профиль СУИQT[27].
-
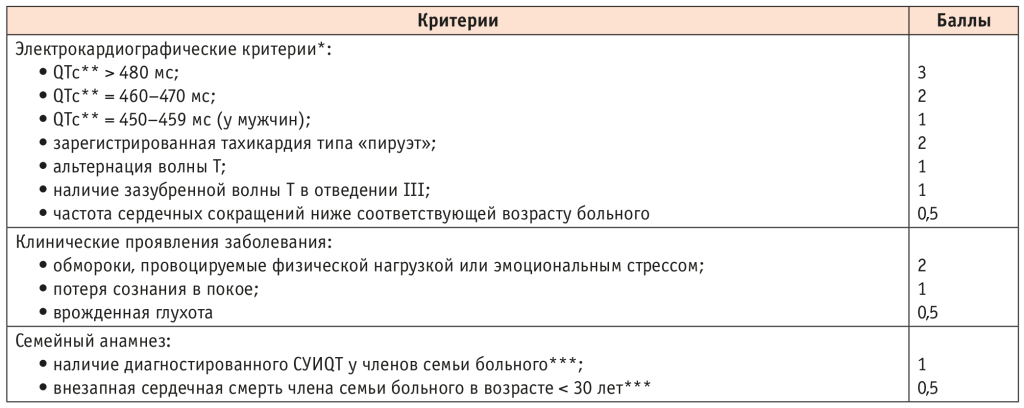
Использование предложенных Р.J. Schwartz и соавт. в 1985 г. больших и малых диагностических критериев (обновлены в 1993 г., а затем в 2006 г.). Врожденный СУИQT с высокой долей вероятности диагностируется при сумме баллов ≥ 3,5 (табл. 2).
Таблица 2. Диагностические критерии врожденного синдрома удлиненного интервала QT (СУИQT)[28]
Примечания.
* При исключении вторичных факторов, способных увеличивать длительность интервала QT.
** Рассчитан по формуле Базетта.
*** Один и тот же член семьи не может быть засчитан в оба критерия.
ЛЕЧЕНИЕ
Модификация образа жизни
Здоровый образ жизни имеет большое значение в лечении пациентов с врожденным СУИQT. Рекомендации 36-й конференции, проведенной в г. Бифезда, ограничивают пациентов СУИQT в занятии таким видом спорта, как спортивная ходьба[29]. Необходимо также заметить, что, по рекомендациям Европейского общества кардиологов, предлагается дисквалифицировать из всех соревновательных видов спорта людей с величиной QTc более 440 мс у мужчин и 460 мс у женщин[30].
По многочисленным литературным данным, эмоциональный стресс, воздействие внезапного звукового раздражителя, нарушение сна увеличивают риск развития сердечных событий у пациентов с СУИQT[23, 25, 27].
Следует помнить, что различные электролитные нарушения, в частности гипокалиемия, способны вызывать увеличение интервала QT, поэтому очень важно избегать таких ситуаций, как голодание, обезвоживание, неукротимая рвота, диарея и др.[4]. Нужно исключить из рациона питания лакрицу и грейпфрутовый сок, усиливающие минералокортикоидный эффект гидрокортизона и, как следствие, снижающие уровень калия в крови.
Кроме того, должен быть полностью исключен прием препаратов, удлиняющих интервал QT. Список таких лекарственных средств находится в открытом доступе и должен быть предоставлен пациенту и членам его семьи.
Медикаментозное лечение
Бета-адреноблокаторы (БАБ) являются основными препаратами выбора при лечении врожденного СУИQT, независимо от генотипа. Клинические данные Международного регистра СУИQT свидетельствуют о том, что БАБ более эффективны в предотвращении фатальных нарушений ритма и ВСС у пациентов с LQTS1 (81%), чем у больных с LQTS2 (59%) и LQTS3 (50%)[31]. Это связано с тем, что аритмии при LQTS1 чаще провоцируются усиленной симпатической стимуляцией.
БАБ снижают риск опасных для жизни сердечных событий при СУИQT у взрослых. Однако не все БАБ одинаково эффективны. В этом отношении пропранолол представляется предпочтительным лекарственным средством, благодаря своему блокирующему действию на натриевые каналы и незначительному влиянию на калиевые (рис. 2).
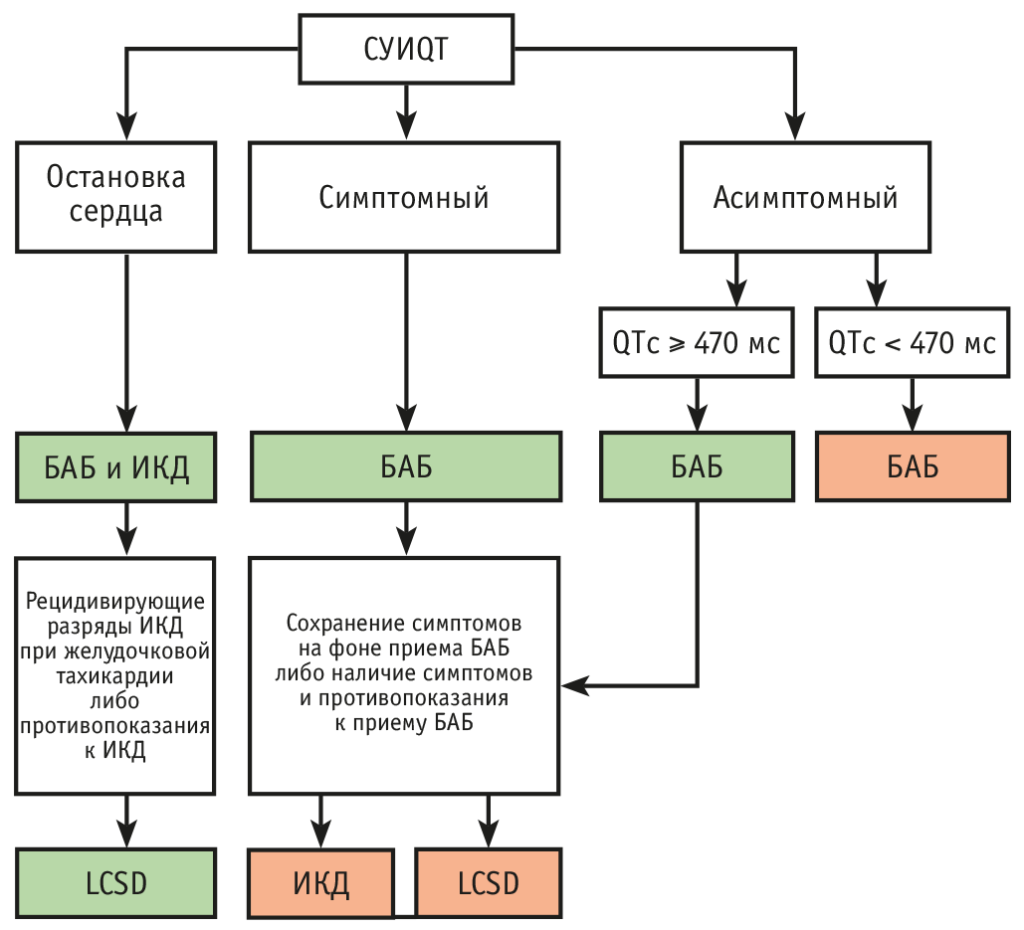
Рис. 2. Схема терапевтического выбора при синдроме удлиненного интервала QT (СУИQT) в соответствии с согласованным документом Heart Rhythm Society/European Heart Rhythm Association/Asia Pacific Heart Rhythm Society от 2013 г.[32].
Примечание. БАБ — бета-адреноблокаторы, ИКД — имплантируемый кардиовертер-дефибриллятор, LCSD — левосторонняя симпатическая денервация сердца (left cardiac sympathetic denervation)
J. Ahn и соавт. в своем метаанализе данных с участием 9727 пациентов продемонстрировали отношение рисков (HR) всех сердечных событий 0,49 (p < 0,001) при использовании БАБ. Эффект от этого класса препаратов наблюдался преимущественно при LQTS1 (HR = 0,59; p < 0,001) и LQTS2 (HR = 0,39; p < 0,001)[33].
Блокатор натриевых каналов мексилетин (в настоящее время не зарегистрирован в Российской Федерации) способен укорачивать интервал QT и снижать бремя сердечных событий у пациентов с LQTS3[12]. Данный препарат может быть рекомендован при абсолютных противопоказаниях к БАБ либо недостаточной их эффективности. Наиболее изученная доза мексилетина — 12–24 мг/кг/день[12].
Интервенционное лечение
Установка имплантируемого кардиовертера-дефибриллятора (ИКД) показана при (класс рекомендаций I):
-
реанимации после остановки сердца;
-
рецидивирующих аритмогенных обмороках, обусловленных TdP, несмотря на терапию БАБ.
Относительные показания к имплантации ИКД включают (класс рекомендаций II):
-
наличие выраженного удлинения интервала QTc (> 550 мс) у бессимптомных лиц, особенно у женщин с LQTS2;
-
наличие абсолютных противопоказаний к приему БАБ.
Важно понимать, что установка ИКД не рекомендуется без предварительной оценки эффективности БАБ[34].
Хирургическое лечение
Альтернативным методом, который доказал свою эффективность, является левосторонняя симпатическая денервация сердца (left cardiac sympathetic denervation, LCSD).
LCSD можно рассматривать в следующих клинических ситуациях:
-
рецидивирующие разряды ИКД при желудочковой тахикардии (класс рекомендаций I);
-
продолжающиеся эпизоды синкопальных состояний, несмотря на оптимальную терапию БАБ (класс рекомендаций I);
-
продолжающееся удлинение интервала QTc > 500 мс у бессимптомных больных, несмотря на оптимальную терапию БАБ (класс рекомендаций IIb);
-
непереносимость БАБ или невозможность/нежелательность установки ИКД (класс рекомендаций IIa).
LCSD включает удаление грудных симпатических ганглиев (Т2–Т4) с сохранением верхней половины звездчатого ганглия (Т1) во избежание развития ятрогенного синдрома Горнера. Выполнение данной операции обосновано хорошим антифибрилляторным эффектом. Однако LCSD связана с повышенным риском развития послеоперационных осложнений, таких как сухость кожи, гипергидроз и покраснение лица по типу синдрома Арлекина[35].
ЗАКЛЮЧЕНИЕ
Ионные каналы представляют собой молекулярные образования, которые участвуют в поддержании разности потенциалов на мембранах кардиомиоцитов, обеспечивая нормальное распространение возбуждения и, как следствие, сокращение сердечной мышцы. Новые знания о структуре данных белков способствуют более глубокому пониманию проблемы каналопатий, в частности СУИQT, который является наиболее хорошо изученным из этой группы заболеваний. Кроме того, продолжающийся прогресс в понимании генетических основ и механизмов развития СУИQT приводит к появлению более эффективных, таргетных, основанных на индивидуальном подходе стратегий лечения синдрома.
Поступила: 13.04.2023
Принята к публикации: 19.09.2023
________
1 Шляхто Е.В., Арутюнов Г.П., Беленков Ю.Н., Бойцов С.А. и др. Национальные рекомендации по определению риска и профилактике внезапной сердечной смерти. М.: ИД «МЕДПРАКТИКА-М»; 2018. 247 с.







