Цель обзора — изложение современных подходов к лечению СКР.
ЭПИДЕМИОЛОГИЯ, ФАКТОРЫ РИСКА И ПАТОГЕНЕЗ
Термин «сосудистые когнитивные расстройства» был введен в употребление V. Hachinski в 1994 г. [23, 52]. Под ним следует понимать когнитивные нарушения любой степени выраженности (легкие, умеренные, тяжелые), причиной которых стало сосудистое поражение головного мозга.
Факторами риска СКР являются пожилой возраст, артериальная гипертензия, нарушения сердечного ритма, патология свертываемости крови, сахарный диабет, гиперлипидемия, изменения состояния сосудистой стенки другой этиологии (васкулиты), перенесенные инсульт и инфаркт миокарда, низкая физическая активность, абдоминальное ожирение и низкий уровень образования.
Говоря об эпидемиологии СКР, следует упомянуть, что по результатам популяционных исследований сделано несколько выводов: 1) распространенность СКР зависит от возраста и удваивается каждые 5 лет; 2) эти нарушения чаще встречаются у мужчин; 3) имеются некоторые различия по распространенности СКР между нациями и странами. В целом распространенность сосудистой деменции колеблется в диапазоне от 2,2% у женщин в возрасте 70–79 лет до 16,3% у мужчин старше 80 лет [62].
В основе развития СКР может лежать как ОНМК, так и хроническое поражение головного мозга (повторяющиеся ОНМК, лейкоареоз) вследствие атеросклероза магистральных артерий головы, кардио- и артерио-артериальных эмболий, нарушения баланса между артериальным притоком и венозным оттоком крови, патологии сосудов мелкого калибра [18, 25, 27, 30, 69]. Характер когнитивных нарушений у пациентов с СКР будет различным: когнитивные симптомы определяются локализацией очагового ишемического поражения. В то же время выраженность когнитивных нарушений будет в большей степени определяться объемом поражения головного мозга либо страданием так называемых стратегических зон — структур мозга, важных для когнитивного функционирования [30, 54]. К таким зонам традиционно относят базальные ганглии, таламус, гиппокамп, ствол головного мозга и лобные доли. При вовлечении «стратегической» зоны для развития когнитивных симптомов объем поражения вещества головного мозга должен быть не менее 10 см3 [45]. Если «стратегическая» зона интактна, суммарный объем некроза должен составлять примерно 50–100 см3 [41, 84].
Различают несколько вариантов формирования СКР:
1) ОМНК с поражением «стратегических» зон. Когнитивные нарушения развиваются остро, дальнейшее их течение при однократном инсульте обычно стационарное;
2) мультиинфарктное поражение белого вещества головного мозга и подкорковых структур. Когнитивные нарушения будут развиваться прогредиентно, возможно, ступенеобразно. Пациент часто не знает о перенесенных инсультах, поскольку они не проявлялись никакой неврологической симптоматикой («немые» инфаркты);
3) диффузное поражение белого вещества (лейкоареоз) без перенесенных ОНМК также характеризуется постепенным ухудшением когнитивных функций (болезнь Бинсвангера). На фоне прогредиентного течения отмечаются колебания выраженности когнитивных, эмоциональных и поведенческих расстройств (флюктуации), обычно связанные с колебаниями выраженности сердечно-сосудистой (АД, ЧСС, аритмии) и иной соматической патологии (сахар крови, лактатацидоз, гиповолемия и т. д.). Следует отметить, что современные методы нейровизуализации позволили уточнить природу поражения головного мозга в этом случае и показали, что обычно лейкоареоз сочетается с мультиинфарктным поражением головного мозга [23];
4) развитие когнитивных нарушений после перенесенного пациентом инсульта, большого по объему. По данным H. J. Lin и соавт., инсульт повышает риск развития деменции в среднем в 4 раза [64]. Сходные данные опубликованы T. Pohjasvaara и соавт. [75].
Согласно общепринятым классификациям, постинсультные когнитивные нарушения могут быть установлены, если их дебют совпадает со временем развития инсульта и они сохраняются через 3 месяца после ОНМК. Следует учитывать, что инсульт может быть не только причиной развития когнитивных нарушений, но и фактором, инициирующим развитие когнитивных расстройств иной этиологии. Чаще всего это манифестация БА — нейродегенеративного заболевания, клинические проявления которого возникают лишь через 10–15 лет от начала развития болезни [23]. В таком случае правильно говорить не о постинсультном когнитивном расстройстве, а о развитии БА.
Исследование, выполненное В. А. Парфёновым и соавт., показало, что инсульт вносит весомый вклад в возникновение и дальнейшее развитие когнитивных расстройств. Так, в ходе анализа когнитивных нарушений у пациентов с легким неврологическим дефицитом и без афазии когнитивные нарушения были выявлены у 68% обследованных в остром периоде инсульта, в то время как в постинсультном периоде их частота составила 83%, при этом у 53% больных нарушения соответствовали критериям умеренных когнитивных расстройств (УКР), а у 30% была выявлена деменция [31].
Ретроспективный анализ показал достоверное нарастание выраженности когнитивных нарушений у лиц, перенесших инсульт. Так, когнитивные нарушения отмечались у 26% пациентов до развития у них инсульта и у 60% — через три месяца после перенесенного инсульта [25, 27]. Однако, по данным подробного анализа их качественных характеристик, у 32% больных эти нарушения в постинсультном периоде соответствовали БА. Таким образом, проведенные исследования убедительно продемонстрировали, что в трети случаев когнитивные нарушения после ОНМК не являются следствием перенесенного инсульта, а развиваются в рамках манифестации текущего нейродегенеративного процесса.
Исследование R. Barba и соавт. показало, что когнитивные нарушения, в том числе тяжелые, часто предшествуют инсульту. В исследование были включены 324 пациента, которые перенесли инсульт; у 15% обследованных деменция отмечалась до развития ОНМК. Пациенты с тяжелыми когнитивными нарушениями были достоверно старше и имели низкий уровень образования, группа пациентов с тяжелыми когнитивными нарушениями состояла преимущественно из женщин. У лиц с деменцией были выявлены как длительный анамнез сердечно-сосудистой патологии и сосудистых факторов риска, так и бо́льшая выраженность церебральной атрофии (преимущественно височных долей головного мозга) согласно результатам МРТ; нейровизуализация показала также достоверно бо́льшую распространенность лейкоареоза. Таким образом, вероятно, бо́льшая часть случаев деменции обусловлена не сосудистым поражением головного мозга, а сочетанием цереброваскулярной патологии с текущим нейродегенеративным процессом [38]. Проведенные исследования также продемонстрировали, что наличие деменции прогностически неблагоприятно, уровень смертности у пациентов с деменцией выше. Этот факт очевиден, и его легко объяснить, если расценивать деменцию как декомпенсацию когнитивных функций вследствие поражения большого объема вещества головного мозга.
Клинические данные подтверждаются морфологическими исследованиями. Так, при клинико-морфологическом сопоставлении у 77% пациентов с прижизненным диагнозом «сосудистая деменция» были выявлены сенильные бляшки и нейрофибриллярные клубочки, в то время как у 16–48% пациентов с прижизненно диагностированной БА — лакунарные инфаркты и лейкоареоз [23, 39, 47, 55, 61].
М. А. Чердак и соавт. выполнили исследование по изучению роли сосудистых и нейродегенеративных факторов в развитии постинсультных когнитивных нарушений у пациентов, перенесших ишемический инсульт. В исследование вошли 120 пациентов (64 женщины и 56 мужчин) в возрасте от 55 до 85 лет. Было выявлено, что когнитивные расстройства проявляются в том числе нарушениями поведения, а также изменением эмоциональной сферы, чаще всего развитием депрессии и апатии. Когнитивные нарушения, развившиеся после инсульта, имели тенденцию к спонтанному уменьшению, что было в большей степени характерно для СКР и в меньшей степени — для нейродегенеративных когнитивных расстройств. Наиболее полно восстанавливались нейродинамические и исполнительные функции [28].
С учетом вышесказанного, необходимо более подробно остановиться на процессах, которые лежат в основе восстановления или улучшения когнитивных функций у пациентов, у которых когнитивные нарушения развились вследствие инсульта. Положительная динамика когнитивных функций в данном случае может быть следствием нейропластичности и реадаптации.
Нейропластичность, в свою очередь, можно разделить на нейрогенез и микроструктурные и функциональные изменения сохранных нейронов [8, 86]. Нейрогенез в большей степени характерен для периинфарктной зоны в восстановительном периоде инсульта, часто описываемые локализации нейрогенеза — субгранулярная зона зубчатой извилины гиппокампа и субэпендимальные отделы боковых желудочков [5]. В периинфарктной зоне происходит вовлечение новообразованных нейронов/астроцитов/олигодендроцитов в нейрональные сети вследствие образования новых синаптических и функциональных связей с другими нейронами [5, 11, 29, 34, 46, 51, 58, 76].
Однако только синаптический нейрогенез не может в достаточной степени обеспечить восстановление функции, утраченной вследствие инсульта. Значительная роль принадлежит микроструктурной и функциональной перестройке уже существующих нейронов. Формирование новых навыков, умений, знаний морфологически проявляется изменением числа шипиков и дендритов нейронов головного мозга с последующим образованием новых синапсов и новых нейрональных сетей [8, 29]. Подобные процессы отмечаются у пациентов с постинсультными когнитивными нарушениями. Проведенные исследования подтвердили, что у пациентов, склонных к восстановлению когнитивных функций или уменьшению выраженности когнитивных расстройств, отмечается активная структурно-функциональная перестройка нейронов и их связей, особенно в отделах противоположного полушария, симметричных пораженному очагу [8, 42, 48, 65, 67, 83, 87].
В отличие от нейропластичности, пик которой приходится на первые месяцы после перенесенного пациентом ОНМК, реадаптация способна улучшить когнитивные и иные функции пациента как на ранней стадии восстановления, так и в значительно более поздний период. Суть этого адаптационного механизма сводится к уменьшению функционального дефекта путем приспособления, например, здоровая рука может взять на себя часть функций руки, ослабленной вследствие пареза [1, 11, 16, 81].
Ухудшение памяти — состояние, типичное для пациентов как с подкорковым СКР, так и с амнестическим вариантом УКР [18, 20]. Гиппокамп представляет собой гетерогенную структуру, состоящую из нескольких анатомически и функционально раздельных структур, которая отвечает за консолидацию информации из кратковременной памяти в долговременную. До сих пор неясно, какие зоны гиппокампа преимущественно страдают у пациентов с СКР и какие — при амнестическом варианте УКР. X. Li и соавт. выполнили исследование, в котором приняли участие 26 пациентов с СКР, 26 — с амнестическим вариантом УКР и 26 добровольцев без когнитивных нарушений. Группы были сопоставимы по полу, возрасту и уровню образования. Авторы применили автоматизированный метод сегментации гиппокампа для оценки объема нескольких гиппокампальных зон, включая аммонов рог (CA: 1–4), зубчатую фасцию гиппокампа, или зубчатую извилину (gyrus dentatus — DG), опорную структуру гиппокампа (subiculum) и зону около нее (presubiculum). Результаты показали у пациентов с СКР меньшую атрофию гиппокампа, чем в группе с амнестическим вариантом УКР, несмотря на отсутствие значительных различий в баллах по краткой шкале оценки психического статуса (Mini-Mental State Examination — MMSE). Сравнение пациентов c СКР с группой контроля показало, что при СКР достоверно снижается объем левой subiculum с presubiculum и правого CA4/DG [63]. Таким образом, патологический процесс при нейродегенеративном и ишемическом поражении головного мозга может затрагивать структуры гиппокампового круга, но при этом степень их поражения и локализация будут различны. Подобное мнение высказывается и другими исследователями [59].
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Следует отметить, что клиническая картина нарушений памяти у пациентов с СКР и с амнестическим вариантом УКР будет различаться. При наличии амнестического варианта УКР будут отмечаться так называемые гиппокампальные нарушения памяти, проявляющиеся снижением объема отсроченного воспроизведения запоминаемой информации по сравнению с объемом непосредственного воспроизведения, а также неэффективностью семантического опосредования (подсказки). У пациентов с СКР на первый план выйдут регуляторные нарушения памяти — объем как непосредственного, так и отсроченного воспроизведения информации будет в значительной степени увеличиваться при введении организующей методики (подсказки), привлечении внимания пациента, а также будет зависеть от скорости психических процессов, способности к созданию программы действий и к контролю над ее выполнением. В клинической картине СКР будут преобладать симптомы лобно-подкорковых отделов и связей головного мозга: зрительно-пространственные нарушения, снижение скорости психических процессов, снижение и колебание уровня внимания (истощаемость), недостаточность «управляющих» функций головного мозга [23, 26] (табл. 1).
Таблица 1
Симптомы и локализация инсульта при расстройстве «управляющих» когнитивных функций [12]

Н. В. Вахнина и соавт. приводят данные, согласно которым клинические признаки поражения передних отделов головного мозга, а также их связей характерны для всех пациентов с СКР, развившимися вследствие инсульта. В 2/3 случаев клинические и нейропсихологические признаки поражения лобных долей и их связей были основными клиническими симптомами [2, 12, 22]. Следует отметить, что другими исследователями эти данные не подтверждены: по наблюдениям T. Pohjasvaara и соавт., например, нарушение «управляющих» функций отмечается всего у 40% пациентов, перенесших инсульт [74]. Видимо, столь широкий разброс данных является результатом гетерогенности выборки пациентов.
Исследование когнитивных функций у пациентов с СКР должно выполняться несколько раз, в разные сроки от момента развития диагностированного ОНМК. Согласно результатам исследования, выполненного Л. В. Климовым и соавт., данные, полученные при анализе выраженности когнитивных расстройств у пациентов в первые дни инсульта, коррелируют с результатами более подробного нейропсихологического обследования, проведенного через несколько недель [14, 17]. Таким образом, нейропсихологическое исследование, выполненное пациенту в остром и острейшем периодах инсульта, может иметь прогностическое значение — давать основания для прогноза развития когнитивных нарушений и их динамики в раннем и восстановительном периодах ОНМК.
Диагностику когнитивных нарушений у пациентов с СКР значительно осложняет наличие сопутствующих эмоциональных расстройств, особенно депрессии и апатии. При депрессии и СКР отмечаются сходные когнитивные нарушения: уменьшение скорости психических процессов, снижение уровня внимания, дисфункция лобно-подкорковых связей. Когнитивные нарушения типичны для депрессии и в ряде случаев могут достигать степени тяжелых когнитивных расстройств — при этом следует говорить о наличии у пациента «псевдодеменции». В свою очередь, депрессия — типичное клиническое проявление церебральной ишемии. По данным ряда исследователей, депрессия отмечается в 30–60% случаев СКР [21, 23, 35, 36, 53, 77]. Апатия может быть как следствием депрессии, так и результатом поражения передних отделов головного мозга и их связей. Сочетание когнитивных нарушений с апатией и депрессией приводит к обязательному нарастанию выраженности когнитивных расстройств.
Сложность диагностики эмоциональных нарушений у пациентов с СКР связана и с тем, что пациенты редко предъявляют жалобы на депрессию. В основе клинических проявлений депрессии при СКР, или сосудистой депрессии, лежит снижение настроения, психической и физической активности без ощущения самой депрессии — тоски, чувства вины; при этом когнитивные и соматические симптомы, напротив, присутствуют чрезвычайно широко. Пациенты отмечают снижение уровней внимания и памяти, замедленность мышления, ощущение «неясной головы». Депрессия в таком случае может быть выявлена методом активного расспроса и анкетирования (таблица 2).
Таблица 2
Диагностические критерии сосудистой депрессии [23, 33]
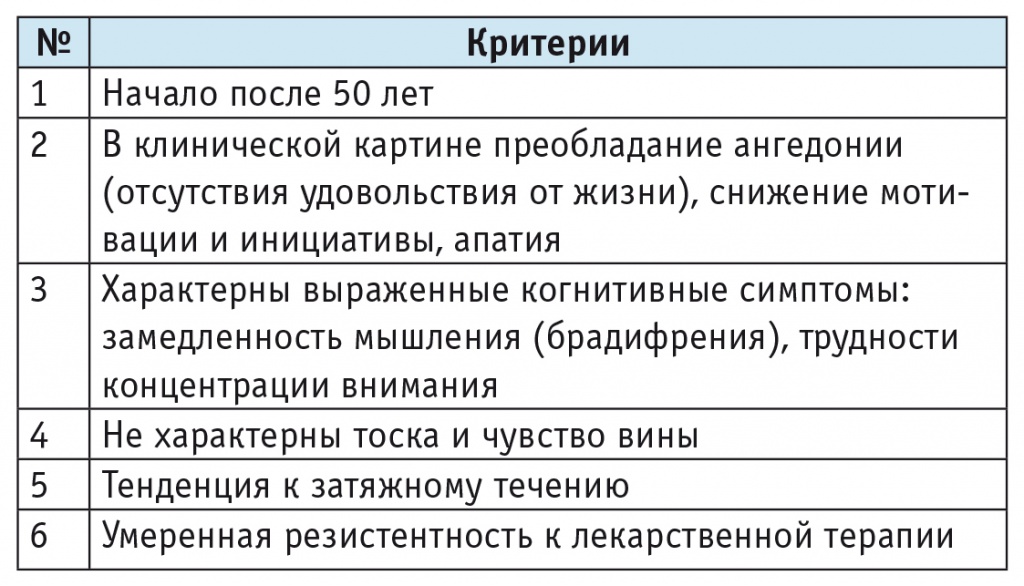
Согласно клиническим рекомендациям прошлых лет, сочетание депрессии и СКР являлось основанием для назначения антидепрессантов и повторного проведения нейропсихологического обследования с целью выявления характера и выраженности когнитивных нарушений после купирования депрессии. Однако опубликованные результаты исследований последнего времени свидетельствуют, что некоторые антидепрессанты (например, ингибиторы обратного захвата серотонина) могут оказывать положительное действие на когнитивные функции при СКР и в отсутствие депрессии — при назначении этих препаратов отмечаются увеличение скорости психических процессов, повышение уровней внимания и мотивации [56, 78]. В то же время у молодых людей, имевших депрессию и вторичные когнитивные нарушения, коррекция эмоциональных нарушений не приводила к полному восстановлению когнитивных функций [15, 44].
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА
Современный подход к лечению когнитивных нарушений любой этиологии должен включать как лекарственные, так и нелекарственные методы. Лекарственные методы в соответствии с очередностью применения подразделяются на патогенетическую терапию, базовую симптоматическую терапию и неспецифическое лечение. Нелекарственные методы включают когнитивный и моторный тренинг, психотерапию, когнитивную стимуляцию.
Лекарственные методы. Патогенетическая терапия СКР состоит из своевременного выявления и коррекции сердечно-сосудистой патологии, устранения сосудистых факторов риска. При выявлении у пациента СКР основу лечения когнитивных нарушений составляют нормализация АД, уровня глюкозы крови; коррекция гиперлипидемии, нарушений сердечного ритма; назначение препаратов, улучшающих показатели свертываемости крови; отказ от курения и т. д. Многочисленные клинические исследования показали, что адекватная коррекция сердечно-сосудистой и иной соматической патологии, даже без дополнения схемы лечения препаратами базовой симптоматической терапии, позволяет достичь существенной положительной динамики когнитивных функций, а также отсрочить дальнейшее развитие когнитивных нарушений и наступление деменции [3, 9, 24, 80]. Пациента необходимо проинформировать о важности изменения жизненного уклада: кроме отказа от курения, желательно изменить пищевые привычки и употреблять в пищу преимущественно овощи, фрукты, рыбу и мясо птицы, избегая животных жиров и мяса животных; при наличии избыточного веса следует позаботиться о его снижении, а также увеличить как физическую, так и умственную активность.
Базовая симптоматическая терапия СКР включает два класса лекарственных препаратов — ингибиторы ацетилхолинэстеразы (АХЭС-И) и антагонисты NMDA-рецепторов. Применение АХЭС-И у пациентов с СКР спорно, исследователями высказываются разные мнения. Так, учитывая морфологию ацетилхолинергических путей (данные пути локализованы преимущественно в перивентрикулярных отделах белого вещества головного мозга и, соответственно, могут страдать как вследствие лейкоареоза, так и при образовании лакун и инфарктов большего объема в этих областях), можно предположить дефицит ацетилхолина при СКР разной степени выраженности. Тем не менее многие исследователи отмечают, что преимущественный эффект АХЭС-И проявляется у пациентов с сосудистой деменцией легкой и умеренной степени выраженности при наличии сопутствующего нейродегенеративного заболевания [40]. Таким образом, вопрос о применении АХЭС-И как средств базовой симптоматической терапии на стадии тяжелых когнитивных нарушений остается открытым. К сожалению, данные об использовании АХЭС-И в качестве средств базовой симптоматической терапии у пациентов с легкими и умеренными когнитивными нарушениями еще более неутешительны: исследования не показали значимой эффективности терапии АХЭС-И при когнитивных нарушениях, не достигающих стадии деменции [26, 30].
Для анализа эффективности второй группы препаратов базовой симптоматической терапии — антагонистов NMDA-рецепторов — следует подробнее остановиться на строении и функции глутаматергической системы. Глутаматергический синапс включает два типа ионных каналов: медленные и быстрые. Медленные каналы снабжены NMDA-рецепторами и открываются только при активации быстрых каналов, снабженных AMPA-рецепторами, что, в свою очередь, приводит к изменению мембранного потенциала [11, 42, 65, 87]. В состоянии покоя ионы магния держат кальциевые каналы закрытыми. При открытии кальциевых каналов происходят поступление ионов натрия в клетку и выход ионов кальция из клетки. Мемантин — обратимый блокатор NMDA-рецепторов — фактически выполняет функцию ионов магния, но с бо́льшим сродством к белкам мембраны нейрона [10, 70, 82]. При отсутствии последующей активации мембранный потенциал клетки длительно находится в «отклоненном» состоянии, в связи с этим повторное возбуждение постсинаптической мембраны достигается существенно легче, что дает основание для развития так называемого феномена проторения пути — облегчения прохождения импульсов по активным и функционально нейрональным значимым сетям [11, 42, 65, 87].
В условиях нарушения синаптической передачи в глутаматергических синапсах постсинаптическая потенциация развивается как в функционально значимых, так и в функционально незначимых синапсах, тем самым затрудняя процессы восстановления и обучения [4, 6, 7, 11]. В таких случаях мемантин (Акатинол мемантин) способствует нормализации синаптической передачи, дозированно повышая порог чувствительности постсинаптической мембраны [4, 7, 37].
Препарат хорошо переносится и в сопоставлении с другими средствами базовой симптоматической терапии обладает сравнительно небольшим числом побочных эффектов и противопоказаний, что является особенно полезным качеством для лекарственного средства, используемого в терапии у пожилых пациентов с широким спектром соматической патологии.
Многочисленные клинические исследования убедительно продемонстрировали эффективность мемантина (Акатинола мемантина) в лечении сосудистой и смешанной деменции любой степени выраженности (легкой, умеренной и тяжелой). Все выполненные исследования были рандомизированными, двойными слепыми и плацебо-контролируемыми. На фоне применения обсуждаемого препарата у пациентов достоверно уменьшалась выраженность когнитивных расстройств — по данным J. M. Orgogozo и соавт., G. Wilcock и соавт., уменьшение составило в среднем 2 балла по шкале ADAS-cog (Alzheimer Disease Assessment Scale — cognitive) [68, 85], — что сочеталось со снижением выраженности нарушений поведения, повышением адаптации в повседневной жизни и качества жизни в целом. Исследования показали также хороший эффект мемантина (Акатинола мемантина) в лечении недементных (умеренных) когнитивных нарушений, особенно при преобладании среди когнитивных расстройств нарушений «управляющих» лобных функций [13, 19, 32]. Эти результаты делают мемантин (Акатинол мемантин) препаратом выбора в терапии УКР, в том числе СКР.
Интересна эффективность применения мемантина (Акатинола мемантина) в раннем и восстановительном периодах инсульта. Исследования, выполненные В. А. Парфёновым и соавт., показали, что на фоне терапии этим препаратом в восстановительном периоде ОНМК достигается не только положительная динамика когнитивных функций, но и уменьшение инвалидизации пациента в целом [22]. Сходные результаты получены S. Petrilli и соавт. [73]. Анализ эффективности применения мемантина (Акатинола мемантина) в остром периоде ишемического инсульта показал его достоверное положительное влияние как на скорость и качество восстановления когнитивных функций, так и на качество реабилитации пациентов [60]. Полученные данные позволяют рекомендовать применение мемантина (Акатинола мемантина) в целях базовой симптоматической терапии у пациентов с СКР любой степени выраженности, а также для быстрой и качественной реабилитации пациентов на фоне ОНМК.
Нелекарственные методы. Следует отметить, что практически все исследования, посвященные изучению эффективности когнитивного и моторного тренинга у пациентов с когнитивными нарушениями, выполнены без учета этиологии когнитивных расстройств. Вероятно, общие правила тренинга сходны, различие составляет только поражение тех или иных когнитивных функций, над которыми и будет осуществляться работа, однако оценка эффективности разных видов когнитивного и моторного тренинга, несомненно, нуждается в дополнительном анализе.
Так, R. Kawashima и соавт. опубликовали результаты проведенного в 2013 г. исследования по оценке эффективности обучающей терапии у пациентов с БА и сосудистой деменцией. Группа контроля получала стандартную лекарственную терапию. Участники интервенционной группы выполняли упражнения, в рамках которых необходимо было рассказывать истории и решать арифметические задачи, при этом каждый пациент получал индивидуальную программу занятий. Данные методы, по мнению авторов, могли увеличить объем рабочей памяти и, как следствие, улучшить абстрактное мышление и повысить скорость решения задач. Занятия проводились 3–5 раз в неделю по 15 минут. Через 6 месяцев исследования в основной группе отмечалось увеличение баллов по шкале MMSE с 15,8 до 18,2, по шкале FAB (Frontal Assessment Battery) — с 6,6 до 7,7, в то время как в группе контроля по MMSE произошло снижение на 2,5 балла, а показатели FAB остались без изменений [57].
T. Ngandu и соавт. проведено предварительное двойное слепое рандомизированное контролируемое исследование клинической эффективности мультидоменного подхода в профилактике ухудшения когнитивных функций у пожилых лиц, находившихся в группе риска развития когнитивных расстройств. В исследование были включены 1260 человек в возрасте 60–77 лет. Участников рандомизировали в соотношении 1 : 1 в две группы: мультидоменную группу интервенции (диета, физические упражнения, когнитивный тренинг, мониторинг сосудистых факторов риска) и группу контроля (общие советы по здоровью). Окончательное исследование результатов было выполнено по показателям 591 участника группы интервенции и 599 участников группы контроля [66].
Интервенция диетой проводилась диетологами на основе финских рекомендаций по питанию и включала 3 индивидуальных занятия и 7–9 групповых. На индивидуальных занятиях осуществлялся подбор диеты, на групповых — пациенты участвовали в дискуссиях и выполняли практические упражнения для облегчения изменения образа жизни. Участникам советовали придерживаться следующей диеты: 10–20% ежедневной энергии получать от протеинов; 25–35% — от жиров (менее 10% от насыщенных и трансжирных кислот, 10–20% от мононенасыщенных жирных кислот и 5–10% от полиненасыщенных жирных кислот, в их числе 2,5–3 г в день должны были составлять жирные кислоты омега-3); 45–55% — от углеводов (с потреблением 25–35 г в день пищевых волокон) и 5% ежедневной энергии — от алкоголя; норма потребления соли — менее 5 г в день. Всего этого удалось достигнуть путем включения в рацион большого количества фруктов и овощей, цельнозерновых, нежирных молочных и мясных продуктов, а также рыбы (не менее двух порций в неделю), ограничения приема сахарозы (менее 50 г в день) и использования растительного маргарина и рапсового масла вместо сливочного масла [66].
Физические упражнения выполнялись под руководством физиотерапевта в тренажерном зале и предусматривали тренировку мышечной силы, аэробную нагрузку. В общий план занятий были включены упражнения на улучшение постурального баланса [66].
Когнитивный тренинг в группах проводился психологом, индивидуальный тренинг включал в себя тренировку различных познавательных функций с использованием компьютерных программ [66].
Анализ полученных результатов показал, что у пациентов основной группы динамика когнитивных функций была достоверно лучше. Межгрупповые различия достигли статистической значимости через год наблюдения [66].
Эффективность моторного тренинга в отношении когнитивных расстройств изучалась в различных исследованиях. Согласно полученным данным, физические упражнения положительно влияют на состояние церебрального метаболизма, а также на функциональную активность сердечно-сосудистой системы. Эффект моторного тренинга при коррекции когнитивных нарушений, вероятно, обусловлен сочетанным действием непосредственно на мозг и на выраженность сердечно-сосудистой патологии и сосудистых факторов риска. Следует отметить также, что физические упражнения способствуют таким процессам, как ангиогенез и артериогенез (возникновение новых капилляров и увеличение в диаметре существующих сосудов), это делает несомненно полезным их применение у пациентов с СКР [79].
Стандартных программ моторного тренинга не существует. Некоторые сложности представляет и анализ динамики отдельных когнитивных функций на фоне его проведения. Так, N. Gates и соавт. в своем исследовании у пациентов с УКР продемонстрировали положительное действие аэробных нагрузок на скорость психических процессов, но не на улучшение памяти, в отличие от тренинга с сопротивлением, который может оказывать влияние и на мнестические функции [49]. Учитывая тот факт, что бо́льшая часть исследований выполнена без учета нозологической принадлежности пациентов, дифференциальный подход к методам моторного тренинга у пациентов с когнитивными нарушениями различной этиологии требует дальнейшего изучения.
ЗАКЛЮЧЕНИЕ
В лечении сосудистых когнитивных расстройств (СКР) любой степени выраженности наиболее правильным представляется комплексный подход, включающий патогенетическое лечение, базовую симптоматическую терапию, а также нелекарственные методы (когнитивный и моторный тренинг).
Препаратом выбора базовой симптоматической терапии при когнитивных расстройствах сосудистого генеза является мемантин (Акатинол мемантин). Эффективность неспецифической терапии спорна, в связи с чем лечение пациентов с СКР ни в коем случае не следует начинать с применения неспецифических препаратов — ноотропных, нейрометаболических, вазоактивных и других лекарственных средств.
Чрезвычайно важна профилактика повторных нарушений мозгового кровообращения, которые фактически являются основным патогенетическим субстратом формирования СКР. Целесообразна тщательная оценка сопутствующих изменений поведения и эмоциональной сферы пациента с обязательной коррекцией имеющихся расстройств.







